What is Western Blot?
by Marvel Lewi Santoso & Owen Distyan Pusponegoro | Feb, 23, 2023

What is Western Blot?
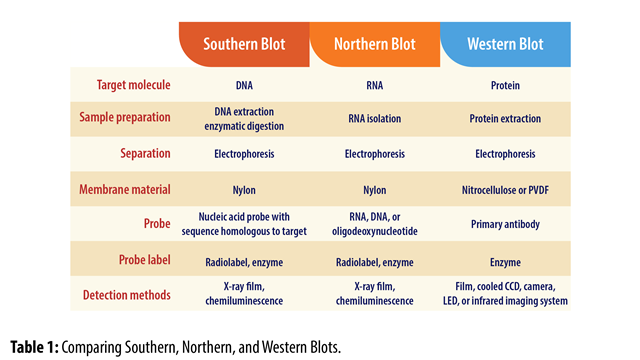
Western Blot, atau juga disebut Protein Immunoblotting, adalah teknik berbasis antibodi yang digunakan untuk mendeteksi keberadaan, ukuran, dan kelimpahan suatu protein tertentu di antara sekumpulan protein dalam sampel. Teknik ini pertama kali dikembangkan oleh Harry Towbin dan rekan-rekannya pada tahun 1979 yang kemudian dinamakan “Western Blot” (Blot Barat), yang merupakan permainan kata dari teknik yang hampir serupa untuk pendeteksian rantai pendek DNA bernama “Southern Blot” (Blot Selatan) yang dipublikasikan empat tahun sebelumnya pada tahun 1975 oleh Edwin Southern. Adapun teknik pendeteksian rantai RNA dinamai “Northern Blot” (Blot Utara) dengan alasan yang sama dengan di atas.
Dasarnya metode blotting yang dimaksudkan dalam teknik Southern, Northern, dan Western Blot adalah proses memindahan dan melekatan materi genetik (DNA atau RNA) atau protein dari dalam gel elektroforesis ke permukaan membran atau kertas sintetik sehingga materi genetik atau protein tersebut dapat dipergunakan untuk proses analisa lebih lanjut. Proses pemindahan ini lebih baik dilakukan karena (1) membran secara struktur lebih kokoh dibandingkan dengan gel sehingga penanganan lebih mudah, dan (2) karena target molekul menempel pada permukaan membran, hal ini memudahkan akses reagen yang akan ditambahkan dibandingkan jika target molekul masih di dalam gel.
Walaupun istilah metode blotting baik itu Southern, Western, ataupun Northern Blot secara spesifik mengacu kepada proses pemindahan materi genetik atau protein ke permukaan membran, istilah ini dapat juga digunakan untuk merujuk proses pendeteksian molekul target melalui metode blotting secara keseluruhan. Baik dari proses elektroforesis materi genetik atau protein hingga pendeteksian molekul target pada membran menggunakan teknik yang sesuai.
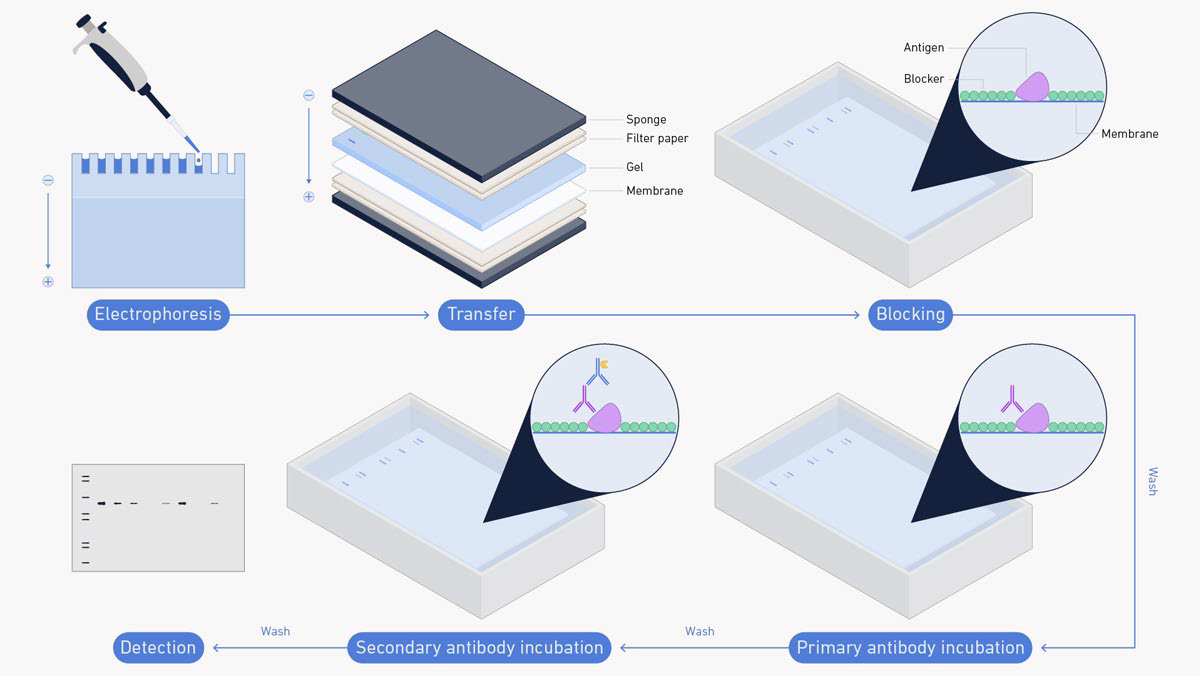
Gambar 1. Alur Kerja Western Blot.
Untuk western blot sendiri, metode pendeteksian protein target pada membran didasarkan pada interaksi spesifik antara protein dengan antibodi. Itulah mengapa metode ini juga terkadang dipanggil “Protein Immunoblotting”. Molekul pelapor seperti enzim atau fluorofor atau molekul dengan radioisotop dan lain sebagainya dapat dikonjungasikan dengan antibodi spesifik target yang kemudian dapat dideteksi secara enzimatis, fluorometri, atau radiologi untuk mengetahui keberadaan dan kelimpahan protein target. Berat molekul protein target pun juga dapat diperkirakan dengan membandingkan terhadap suatu protein standar (semisalnya protein ladder).
Western Blot Gel
Sebelum western blot dapat dilaksanakan, pada umumnya sampel protein harus dipisahkan terlebih dahulu. Untuk memisahkan protein, biasanya digunakan metode elektrolisis protein, seperti Elektroforesis Gel Poliakrilamida dengan Natrium Dodesil Sulfat (SDS-PAGE) atau Elektroforesis Gel Poliakrilamida biasa (Native PAGE). Dengan SDS-PAGE, protein dapat dipisahkan berdasarkan berat molekulnya sedangkan dengan Native PAGE, protein dapat dipisahkan berdasarkan muatan listriknya. Jenis gel yang akan dipergunakan sangat bergantung pada sasaran tujuan analisis yang ingin dicapai.
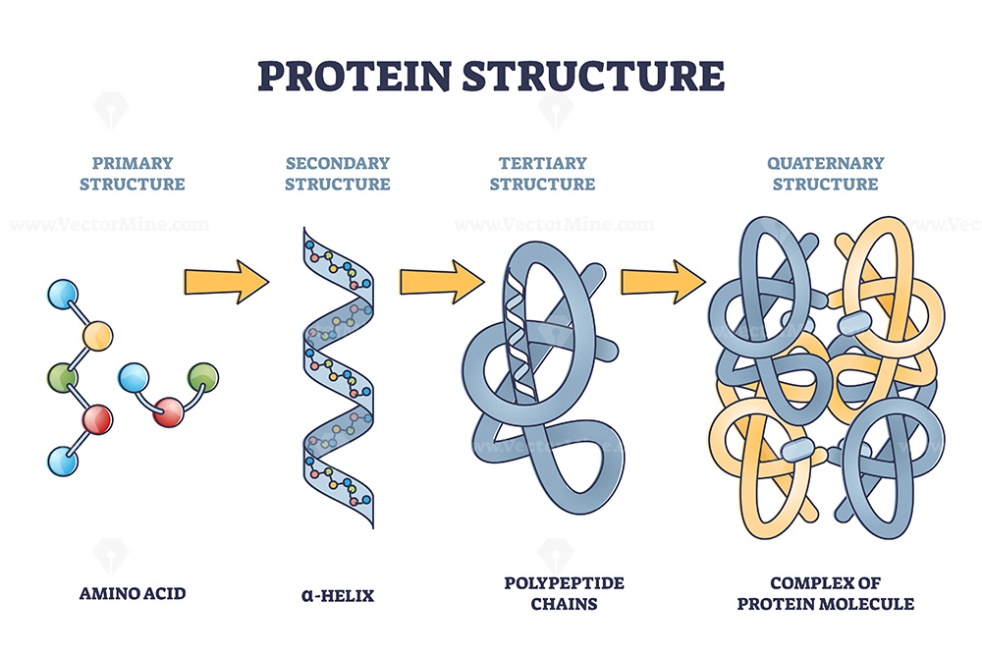
Gambar 2. Struktur protein dari struktur dasar hingga struktur kompleks.
SDS (Natrium Dodesil Sulfat) adalah molekul surfaktan ionik yang dapat mengurai struktur suatu protein kembali menjadi struktur dasarnya, yaitu rantai panjang asam amino (selama tidak terdapat jembatan disulfida). Hal ini terjadi karena SDS dapat melekat pada protein dan menegatifkan muatan listrik pada permukaan protein tersebut. Untaian protein kompleks tersebut dapat kemudian diurai dengan adanya interaksi tolak-menolak antar muatan negatif diseluruh permukaan protein. Fenomena inilah yang menjadi dasar dari metode SDS-PAGE.
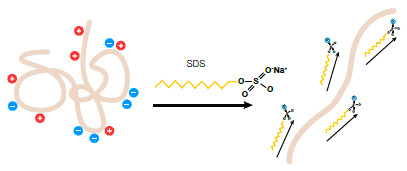
Gambar 3. Efek penambahan SDS pada protein.
Protein Transfer (blotting)
Blotting adalah inti dari metode western blotting. Protein yang akan dianalisa harus ditransfer ke membran yang sesuai sebelum dapat dideteksi mengunakan antibodi. Jenis membran yang umumnya dipergunakan adalah nitroselulosa atau polivinilidena difluorida (PVDF) yang memiliki situs aktif pada permukaannya sebagai tempat protein untuk melekat. Adapun berbagai macam teknik dapat dipergunakan untuk mentransfer protein dari gel ke membran, seperti transfer kapiler, transfer difusi, dan vacuum blotting. Tetapi di antara metode yang ada, electroblotting (yang juga disebut electroelusion atau electrophoretic transfer) adalah metode yang paling banyak dipergunakan karena efisiensi dan kecepatan dari metode ini. Dengan metode electroblotting, gel ditindihkan pada membran lalu diapitkan dengan kertas filter. Kemudian arus listrik dilewatkan melalui tumpukan berlapis ini dan protein akan bermigrasi dari dalam gel ke arah kutub positif. Protein tersebut akan kemudian tertangkap oleh membran di tengah perjalanan migrasinya dan akan melekat pada permukaan membran.
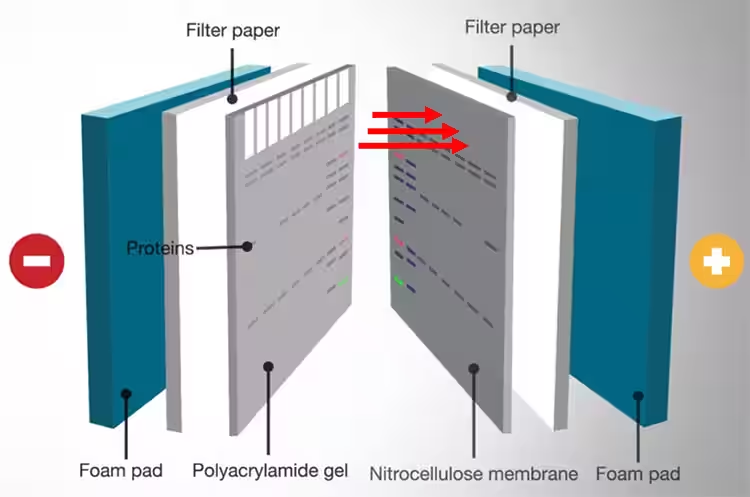
Gambar 4. Proses Western Blot.
Western Blot Blocking and Washing
Karena tidak semua situs aktif pada permukaan membran dapat ditempati oleh protein dari gel, proses pemblokiran situs-situs yang masih aktif tersebut perlu dilakukan. Hal ini dimaksudkan untuk menghindari hal-hal yang tidak diinginkan seperti antibodi pendeteksi juga ikut melekat pada membran yang akhirnya dapat memberikan hasil positif palsu. Proses pemblokiran biasanya dilakukan dengan menginkubasi membran dengan larutan protein yang diketahui tidak mengandung protein target, seperti larutan susu skim atau larutan serum albumin sapi.
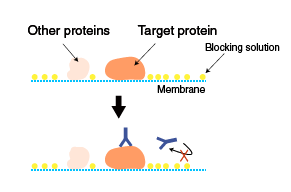
Gambar 5. Blocking solution melindungi membran dari antibodi.
Metode blotting, penting untuk mencuci membran di antara setiap langkah untuk menghilangkan reagen yang berlebih atau yang tidak habis terpakai. Proses pencucian yang tidak sempurna akan meninggalkan sisa reagen pada membran yang dapat mengganggu reaksi selanjutnya sedangkan proses pencucian yang berlebihan akan justru menyebabkan protein target juga ikut terbilas. Untuk menghindari hal tersebut, penting untuk dilakukan optimasi jumlah pengulangan pencucian dan lama waktu pencucian demi mendapatkan hasil bacaan yang terbaik. Larutan penyangga yang umumnya dipergunakan adalah larutan penyangga TBS (tris-buffered saline) atau PBS (phosphate-buffered saline) yang biasanya ditambahkan dengan Tween-20 (sehingga menjadi TBST dan PBST).
Western Blot Antibody
Antibodi dipergunakan untuk mendeteksi keberadaan protein target dalam metode western blot. Metode pendeteksian western blot dapat dibagi menjadi 2, yaitu metode langsung dan tidak langsung. Dengan metode langsung, hanya satu jenis antibodi digunakan untuk mendeteksi protein target sekaligus menjadi antibodi pelapor. Sedangkan dengan metode tidak langsung, antibodi primer hanya berfungsi untuk mendeteksi protein target dan antibodi sekunder hanya berfungsi untuk mendeteksi antibodi primer serta menjadi antibodi pelapor.
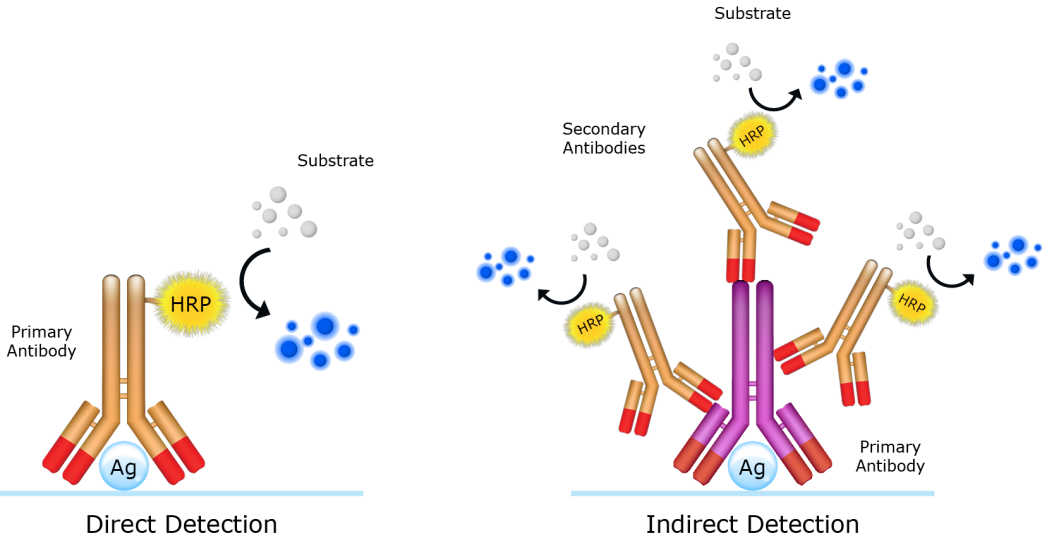
Gambar 6. Perbedaan metode langsung dan metode tidak langsung.
Baik metode langsung maupun tidak langsung memiliki kelebihan dan kekurangannya masing – masing. Dengan metode langsung, proses pengerjaan dapat berlangsung lebih cepat dan lebih sederhana dikarenakan hanya mengunakan satu antibodi saja. Akan tetapi, reaksi imunitas dari antibodi jenis ini dapat menjadi kurang sensitif karena adanya konjugasi dengan enzim, fluorofor, atau konjugat-konjugat yang lain. Selain itu, antibodi jenis ini pada umumnya perlu dirancang untuk berkonjugasi dengan molekul pelapor selain juga harus mengenali protein target, sehingga harga antibodi jenis ini dapat menjadi lebih mahal dibandingkan antibodi untuk metode tidak langsung.
Seperti yang telah disampaikan, metode tidak langsung memiliki kelebihan di mana harga antibodinya dapat menjadi lebih murah karena hanya antibodi primernya saja yang perlu dibuat sedangkan antibodi sekunder biasanya sudah diproduksi secara komersil dan dapat dibeli secara langsung. Sementara itu, antibodi primer ini memiliki reaksi imunitas yang lebih optimal karena antibodi primer tidak dikonjugasikan dengan apa-apa yang dapat menganggu reaktifitasnya. Beberapa antibodi sekunder juga dapat digunakan bersamaan untuk lebih menegaskan sinyal pelaporan dari molekul pelapor yang dapat meningkatkan sensitifitas pendeteksian protein. Meskipun demikian dikarenakan pengunaan dua atau lebih antibodi, proses pengerjaan metode tidak langsung menjadi lebih rumit dan lebih lama. Pengunaan antibodi lebih dari satu dapat juga meningkatkan kemungkinan interaksi tidak spesifik yang dapat menganggu hasil akhir.
Western Blot Analysis
Metode pendeteksian and visualisasi protein pada western blot sangat bergantung dengan jenis molekul yang dikonjugasikan pada antibodi pelapor yang digunakan. Adapun metode yang biasanya dipergunakan adalah metode pendeteksian secara kolometri, secara kemiluminesensi, secara fluoresensi, atau secara radioaktif.
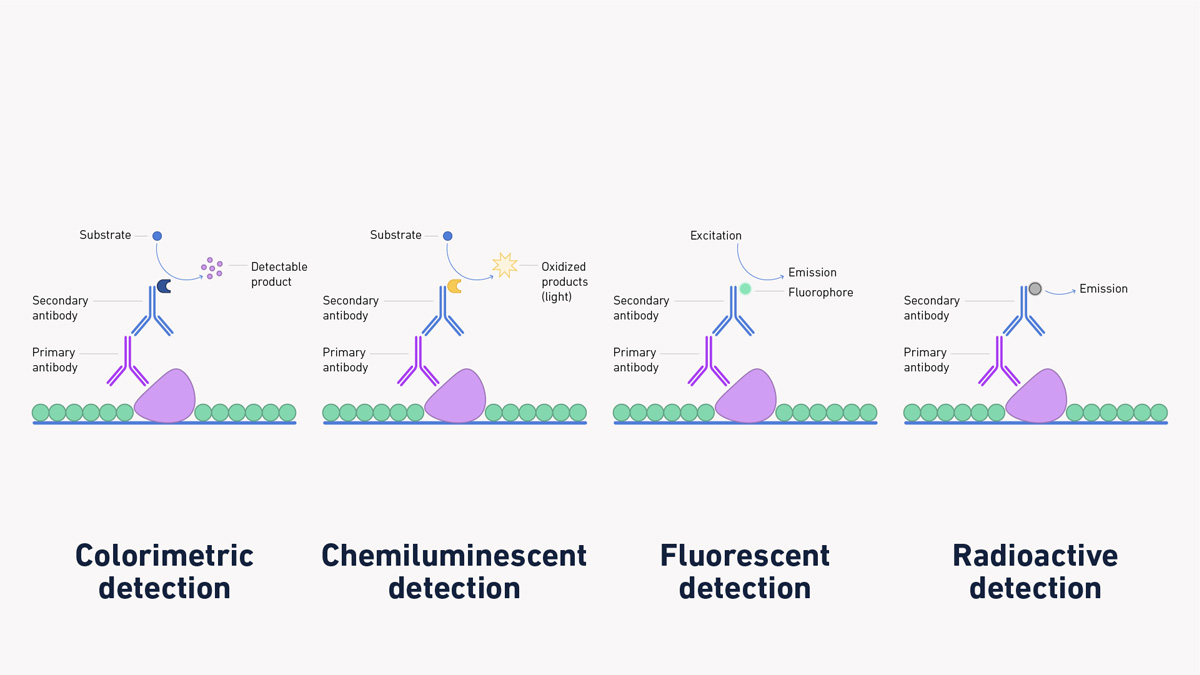
Gambar 7. Beberapa metode pendeteksian western blot.
Metode kolorimetri maupun kemiluminesensi menggunakan antibodi yang terkonjugasi dengan enzim. Enzim yang umumnya dipergunakan adalah peroksida lobak pedas (Horseradish peroxidase, HRP) dan fosfatase alkali (Alkaline phosphatase, AP). HRP lebih umum dipergunakan karena kestabilannya, kemudahannya untuk berkonjugasi dengan antibodi apapun, dan harga yang lebih murah dibandingkan AP. Ketika proses pendeteksian dilakukan, suatu substrat ditambahkan pada membran di mana enzim terkonjugasi akan mengubah substrat tersebut menjadi senyawa berwarna (kolorimetri) atau bereaksi menghasilkan cahaya (kemiluminesensi). Warna atau cahaya yang dihasilkan hanya akan bertahan sepanjang substrat yang ditambahkan belum habis terkonsumsi oleh enzim yang ada sehingga perlu dilakukan perekaman gambar hasil western blot secara langsung.
Metode fluoresensi mengunakan antibodi yang terkonjugasi dengan fluorofor di mana ketika molekul ini dipaparkan dengan cahaya pada panjang gelombang tertentu akan tereksitasi dan memancarkan cahaya dengan panjang gelombang tertentu yang berbeda dengan cahaya yang dipaparkan. Untuk memvisualkan metode ini, alat perekam gambar digital dengan kamera jenis avalanche photodiode (APB), photomultiplier tube (PMT), atau charge-coupled device (CCD) dapat dipergunakan. Walaupun metode ini memerlukan peralatan kamera khusus untuk merekam gambarnya, metode ini tidak memerlukan adanya substrat untuk menghasilkan gambar sehingga metode ini dapat berlangsung lebih cepat. Dengan metode multiplex di mana 2 atau lebih antibodi yang berfluorofor berbeda dapat dipergunakan untuk menganalisa 2 atau lebih protein target secara bersamaan.
Metode radioaktif mengunakan antibodi yang terkonjugasi dengan molekul mengandung radioisotop. Pendeteksian antibodi jenis ini dilakukan dengan merekam emisi sinar radiasi dari radioisotope tersebut menggunakan film X-ray. Pada awalnya, metode ini sering dipergunakan akan tetapi dikarenakan diperlukannya penanganan khusus untuk melindungi si penguna dari paparan sinar radiasi, harga material yang mahal, dan jangka waktu penyimpanan molekul radioaktif yang pendek, metode ini telah banyak digantikan dengan metode – metode pendeteksian yang lain.
SUMBER PUSTAKA
Goldman A, Speicher DW. UNIT 10.7 Electroblotting from polyacrylamide gels. Curr Protoc Protein Sci. 2015;82:10.7.1-10.7.16. doi:1002/0471140864.ps1007s82
Alegria-Schaffer A. Chapter Nineteen – Western blotting using chemiluminescent substrates. In: Lorsch J, ed. Methods in Enzymology. Vol 541. Laboratory Methods in Enzymology: Protein Part C. Academic Press; 2014:251-259. doi:1016/B978-0-12-420119-4.00019-7
Kondo Y, Higa S, Iwasaki T, et al. Sensitive detection of fluorescence in western blotting by merging images. PLOS ONE. 2018;13(1):e0191532. doi:1371/journal.pone.0191532
Product yang Relevan


